Rôles et responsabilités de l’équipe de recherche
Le type de statut de chercheuse ou de chercheur requis et la nécessité d’une chercheuse ou d’un chercheur responsable local(e) dans l’équipe vont dépendre de la nature des activités de recherche et du caractère multicentrique du projet.
- Chercheuse ou chercheur principal(e): Il s’agit de la personne qui assure la responsabilité administrative, financière, éthique et scientifique du projet ou de la programmation de recherche faisant l’objet d’une demande auprès du BGPR. Cette personne peut être membre d’un centre de recherche du CIUSSS (interne) ou provenir d’une autre organisation (externe).
- Chercheuse ou chercheur responsable local(e): personne reconnue par l’établissement comme membre d’un de ses centres de recherche et qui détient un statut de chercheuse ou chercheur octroyé en vertu des dispositions de la Politique relative aux statuts des chercheurs en vigueur au CIUSSS. Elle est répondante locale pour le CER, en plus de s’assurer du respect du cadre réglementaire de la recherche et des politiques afférentes en vigueur dans l’établissement et de l’encadrement des ressources locales, le cas échéant. Cette personne est aussi responsable du recrutement, de la sécurité des participant(e)s de même que de la respectabilité de l’établissement. Considérant le caractère spécifique de chaque projet de recherche, une entente de collaboration interinstitutionnelle devra être signée pour déterminer et formaliser le partage des responsabilités entre la chercheuse ou le chercheur principal(e) et la chercheuse ou le chercheur responsable local(e).
- Co-chercheuse ou Co-chercheur: personne qui participe et contribue de façon significative à la recherche, qu’elle soutient et alimente grâce à son expertise dans le domaine considéré. Le co-chercheur accompagne le chercheur principal et/ou le chercheur responsable local dans la réalisation du projet. Elle peut être une chercheuse ou un chercheur interne ou externe dans le cas d’une étude multicentrique. Le chercheur principal ou le chercheur responsable local est garant de la compétence du co-chercheur et de la qualité du projet dans l’établissement. À ce titre, le co-chercheur n’a pas besoin d’obtenir un statut de chercheur dans l’établissement.
- Équipe de projet: est constituée de plusieurs personnes désignées par la chercheuse ou le chercheur principal(e) comme apportant une contribution spécifique au projet. Ces personnes n’ont pas besoin de disposer d’un statut ou de privilèges de recherche dans le ou les établissements où se déroule le projet.
- Promoteur: instance ou personne qui prend en charge toutes les étapes d’un essai clinique et en assume les responsabilités. Dans la plupart des cas, le promoteur finance aussi l’essai clinique. Il peut s’agir d’une compagnie pharmaceutique ou biotechnologique, d’une université, d’un établissement de soins de santé, d’un groupe bénévole, d’un organisme privé ou d’un organisme de santé gouvernemental, ou encore d’un médecin ou d’un membre du personnel médical. Une entente d’essai clinique devra être déposée dans Nagano.
Le BGPR peut vous accompagner afin de déterminer quelle situation s’applique à votre projet.
Catégorie des projets de recherche
Chaque catégorie de projet (monocentrique ou multicentrique, multicentrique externe) a ses spécificités et nécessite le dépôt du bon formulaire et des documents appropriés. C’est également le cas pour toute demande d’avis au CER.
Projet monocentrique (Mono)
Selon le Cadre de référence des établissements publics du réseau de la santé et des services sociaux, un projet de recherche est dit monocentrique lorsque celui-ci se déroule exclusivement dans un seul site du réseau de la santé et des services sociaux. Cela signifie que toutes les activités de recherche, incluant la collecte de données et l'intervention auprès des participant.es, sont concentrées dans un établissement de santé.
Pour le dépôt d’un projet monocentrique, la chercheuse ou le chercheur doit compléter et déposer un formulaire de demande d’évaluation d’un projet de recherche (de type F11) dans Nagano. Selon le type de projet (voir section 2.3) le F11 à sélectionner et à compléter sera différent.
Projet multicentrique (MP) évalué par un CER du CIUSSS
Un projet de recherche multicentrique est un projet qui se réalise dans plus d’un établissement du réseau de la santé et des services sociaux.
La chercheuse ou le chercheur doit d’abord compléter et déposer un formulaire F0 afin de demander à un CER du CIUSSS d’agir en tant que CER évaluateur (CERE) pour le projet de recherche. Une fois la demande acceptée, la déclaration du CERE sera fournie à la chercheuse ou au chercheur, via la plateforme Nagano. Cette déclaration pourra être transmise aux autres
établissements participants au projet.
L’approbation du formulaire F0 par le CER entrainera la création d’un formulaire F11 adapté au type de projet et d’un numéro de projet commençant par MP-13-20XX-XXXX.
Projet multicentrique externe (MEO) évalué par le CER d’un autre établissement
Un projet MEO est un projet de recherche ayant été évalué par un CER externe au CIUSSS et pour lequel le CIUSSS est un site participant à la recherche.
Selon le Cadre de référence des établissements publics du réseau de la santé et des services sociaux pour l’autorisation d’une recherche menée dans plus d’un établissement, un projet de recherche mené dans plus d’un établissement public du réseau de la santé et des services sociaux est soumis qu’à une seule évaluation éthique, faite par un CER du RSSS. Cette évaluation éthique est ensuite reconnue par chacun des autres établissements faisant partie du projet.
Pour un projet MEO, l’examen éthique ayant déjà été effectué, la chercheuse ou le chercheur doit compléter le formulaire F11MEO, auquel seront joints les documents attestant de la tenue d’une évaluation scientifique, d’une évaluation éthique par le CERE et d’une approbation éthique finale.
Les évaluations scientifique et éthique du projet ayant été faites, le F11MEO permet de déposer une demande d’évaluation de convenance institutionnelle afin de réaliser la recherche au sein du CIUSSS.
Demande d’avis au comité d’éthique (SOFA)
En cas de doutes sur la nécessité d’obtenir une approbation éthique pour un projet, il est possible de demander un avis au CER en complétant et en déposant un formulaire F11SOFA dans Nagano.
Un projet faisant l’objet d’une exemption éthique devra toutefois répondre aux exigences prévues par l'article de la Loi sur les services de santé et services sociaux en ce qui concerne l'accès aux dossiers.
Si vous avez des doutes quant à la nature de votre projet, le BGPR pourra vous soutenir dans cette analyse.
Projet Santé Canada
Un essai clinique est une étude réalisée dans un établissement de santé et de services sociaux sur des personnes participantes volontaires servant à tester l'efficacité et la sécurité d'un traitement expérimental sur des sujets humains, après que celui-ci ait été testé en laboratoire et sur des animaux (recherche préclinique).
Phases de déroulement d’un essai clinique
Pour évaluer et s’assurer de l’efficacité et de la sécurité d’un traitement, les essais cliniques se déroulent généralement en trois ou quatre phases :
- Phase I : Le traitement mis à l’étude (médicament, instrument médical, outil de diagnostic, procédure chirurgicale, vaccin, etc.) est testé chez quelques personnes afin d’en évaluer l’efficacité et la sécurité.
- Phase II : Si les résultats sont concluants, le traitement est testé chez un petit nombre de personnes ou d’individus.
- Phase III : Par la suite, ce traitement est appliqué à un grand nombre de personnes ayant une condition médicale particulière afin d’en évaluer l’efficacité et la sécurité.
- Phase IV : La surveillance du traitement se poursuit même après la commercialisation du traitement ou de l’outil, tant que celui-ci est utilisé par la population. Des études peuvent également être menées pendant cette période pour confirmer l’efficacité du médicament.
Méthode et protocole
Un essai clinique doit suivre une méthode choisie en fonction de l’objectif défini dans le protocole de recherche. Le choix d’une méthode appropriée pour un essai clinique peut être exigé par les organismes gouvernementaux ou les organismes subventionnaires. Pour mener efficacement des essais cliniques, deux méthodes principales sont utilisées : (1) la méthode d’essai clinique non contrôlé et (2) la méthode d’essai clinique contrôlé. Les essais cliniques contrôlés peuvent aussi être menés selon différentes méthodes.
Le processus de développement d'une innovation en santé
Le développement d’une innovation en santé, de sa conception en laboratoire à son utilisation par la population, est un processus très encadré qui suit des règles strictes.
Différentes réglementations provinciales, nationales et internationales régulent et encadrent l’autorisation, le déroulement et la fin des essais cliniques. Si les résultats sont satisfaisants, des autorisations fédérales et provinciales sont requises pour permettre que le nouveau traitement soit accessible à la population.
La chercheuse ou le chercheur principal(e) ayant la responsabilité du projet auprès de l’établissement et le comité d’éthique concerné, en tenant compte des normes de Santé Canada, évaluent le projet de recherche afin de valider sa conformité.
Autorisations requises avant le déroulement d’un essai clinique
En plus de la triple évaluation (scientifique, éthique, convenance) obligatoire pour tout projet de recherche, un essai clinique devant se dérouler au Canada doit aussi faire l’objet d’une approbation par Santé Canada. Un dossier contenant, entre autres, le protocole de recherche ainsi que des informations relatives à la fabrication et à la sécurité du traitement doivent être soumis à Santé Canada avant le démarrage de l’essai clinique. Pour plus d’informations concernant les informations à inclure dans ce dossier, ainsi que les étapes du processus d’une demande d’essai clinique, vous pouvez consulter les lignes directrices de Santé Canada.
Accompagnement pendant le déroulement de l’essai clinique
Lorsque l’autorisation est accordée, l'essai clinique est mis en place dans un ou plusieurs établissements (ou sites), et le recrutement des personnes participantes est amorcé, en conformité avec le protocole de recherche autorisé et le Cadre réglementaire en recherche en vigueur.
Tout au long de l’étude, l’essai est examiné en continu par différents comités, par exemple un Comité indépendant de contrôle des données (CICD). Ces comités sont responsables d’évaluer périodiquement le déroulement, les données et les résultats de l’essai afin d'assurer la sécurité des personnes participantes. Si des effets indésirables apparaissent en cours de projet, ils sont rapportés à différentes instances (CER, Santé Canada, etc.) et mentionnés dans Nagano afin de prendre une décision éclairée quant à la nécessité de suspendre ou d’arrêter l’étude.
Évaluation de l’essai clinique
Au terme de l’essai clinique, les données anonymes recueillies tout au long de sa réalisation sont analysées par la chercheuse ou le chercheur principal(e) ou par le promoteur. Cette étape permet de décider :
- Si les résultats sont prometteurs, et donc si l’évaluation du traitement à l’étude peut se poursuivre en phase suivante ou non (dans le cas d’un essai clinique de phase I ou II); ou encore;
- Si le traitement a fait ses preuves et peut être soumis à Santé Canada pour autorisation, afin de devenir accessible à la population (dans le cas d’un essai clinique de phase III).
Les conclusions de l’essai clinique peuvent aussi être rapportées sous forme d’article scientifique dans une revue médicale spécialisée. Avant d’être publié, l’article est analysé par d’autres scientifiques du même domaine de recherche. Ces spécialistes évaluent la qualité de la démarche et la rigueur scientifique de l’essai clinique, avant d’autoriser ou non la publication.
Les résultats sont publiés tout en préservant l’anonymat des personnes qui ont participé à l’essai clinique.
Interruption d’un essai clinique
Santé Canada, le comité d’éthique, la chercheuse ou le chercheur principal(e) ou le promoteur peuvent mettre fin à un essai clinique à tout moment. Même si ce n’est pas très courant, une interruption d’essai clinique peut survenir en raison de l’apparition d’effets secondaires plus graves que prévus, ou dans le cas où l’efficacité du traitement n’a pu être clairement démontrée. Il arrive aussi que le nombre de personnes recrutées dans l’essai clinique soit insuffisant pour permettre la poursuite de l’étude.
Lorsque survient une interruption d’essai clinique, la chercheuse ou le chercheur principal(e) informe les personnes participantes le plus tôt possible et les renseigne sur les étapes à venir.
Formulaires et documents requis lors du dépôt d’un projet de recherche
Tout projet de recherche déposé dans Nagano nécessite la complétion et le dépôt d’un formulaire F11, ainsi que d’autres documents pertinents pour l’analyse du projet de recherche.
Formulaires à déposer selon le type de projet
Consultez le tableau suivant pour connaitre les formulaires complets à remplir pour chaque type de projet.
Documents requis pour le dépôt d’un projet
Ce tableau présente les documents requis pour le dépôt d’un projet de recherche dans Nagano selon la catégorie multicentrique du projet. Différentes sections sont prévues dans le F11 afin de permettre à la chercheuse ou au chercheur de joindre ces documents.
Dépôt d'un projet
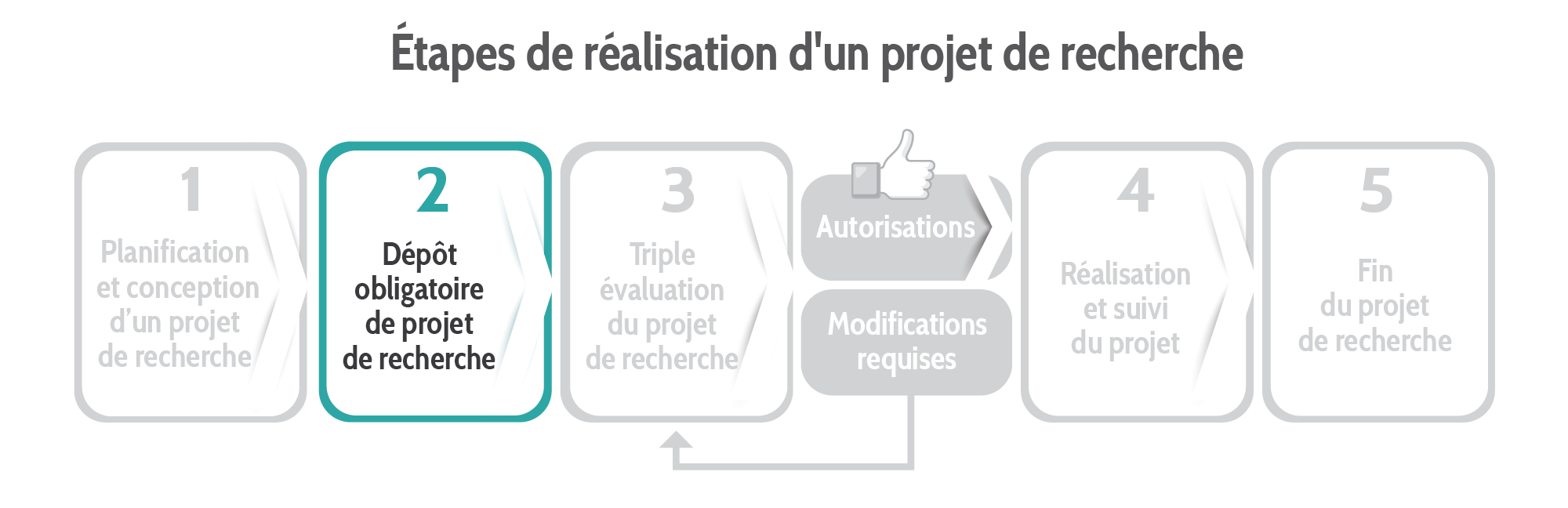
Dépôt obligatoire du projet de recherche dans Nagano
Nagano est un système de gestion des projets de recherche qui permet de centraliser et de gérer en ligne les projets de recherche de l’établissement. Nagano inclut divers modules qui permettent de faire les évaluations éthiques et de convenance, en plus de permettre aux établissements qui l’utilisent d’être interconnectés. Cet outil performant offre un guichet unique pour toute la communauté de la recherche du CIUSSS de la Capitale-Nationale et de plusieurs autres établissements du réseau de la santé et des services sociaux.
Pour avoir accès à la plateforme Nagano, vous devez en faire la demande au BGPR.
Tout projet de recherche doit être déposé dans la plateforme de gestion de projets de recherche Nagano. Afin d’obtenir un accès à la plateforme Nagano du CIUSSS, la chercheuse ou le chercheur doit en faire la demande au BGPR.
Il en est de même pour les membres des équipes de recherche, de même que les étudiantes et étudiants, s’il y a lieu.
Liens utiles
- Captures d'écran dépôt de projet sur Nagano
- Capsule sur l'utilisation de Nagano
- Capsules de formations disponible sur YouTube
Avant de déposer votre projet, vous êtes invité à prendre contact avec le BGPR.
Consultez la page 21 du Guide de la chercheuse et du chercheur pour plus de détails concernant les statuts du dépôt de projet dans Nagano.





